|
Cấu trúc dữ liệu trong WHODrug
WHODrug bao gồm các loại thuốc có tên thương mại riêng lẻ liên quan đến thành phần hoạt tính, dạng dược phẩm, hàm lượng, MAH và quốc gia bán hàng, cũng như phân loại theo phân loại Hóa chất Điều trị Giải phẫu của WHO (ATC - WHO Anatomical Therapeutic Chemical classifcation) (Hình minh họa - Figure 2). WHODrug cũng chứa một số thuật ngữ chung cho thuốc không liên quan đến hoạt chất cụ thể.
Liên kết giữa tên thương mại và thành phần
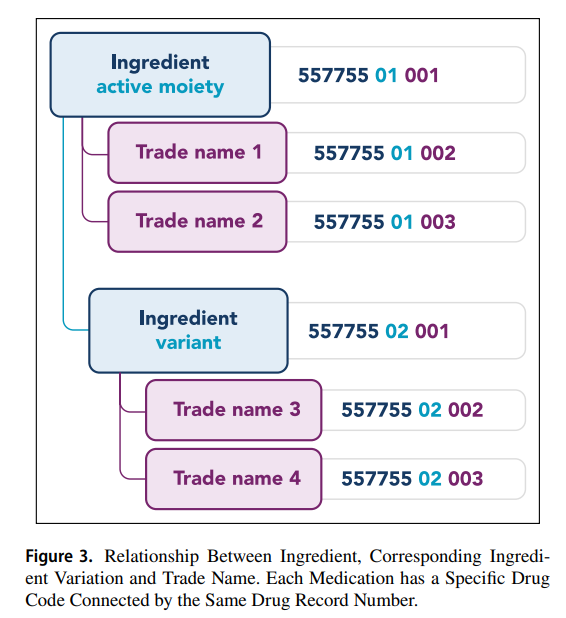
Tất cả các loại thuốc trong WHODrug đều được cung cấp một số nhận dạng duy nhất, Số nhận dạng sản phẩm thuốc (MPID - Medicinal Product Identifcation Number) để phân biệt chúng với nhau bất kể chúng có khác nhau về thành phần “ingredient”, dạng dược phẩm “Pharmaceutical form”, hàm lượng “strength,”, MAH, quốc gia bán hàng hay tất cả những điều trên hay không. Để liên kết các sản phẩm thuốc có liên quan một cách hợp lý, ví dụ như các tên thương mại khác nhau có cùng thành phần hoạt chất hoặc kết hợp thành phần, WHODrug sử dụng một mã bao gồm chữ và số, tức là mã Thuốc “Drug code”. Mã Thuốc “Drug Code” là một dãy gồm 11 ký tự được tạo thành từ ba phần. Phần đầu tiên gồm 6 ký tự (Số hồ sơ thuốc - Drug Record Number) và đại diện cho các thành phần, phần thứ hai bao gồm 2 ký tự (Seq 1) và đại diện cho biến thể của thành phần, và cuối cùng, phần thứ ba bao gồm 3 ký tự (Seq 2) đại diện cho tên thuốc trong WHODrug có thể là tên thương mại, tên gốc hoặc tên không chính xác (Hình minh họa bên dưới).

Xác định tên thương mại không duy nhất
Tên thương mại “Trade Name” giống nhau đôi khi có sẵn với các thành phần khác nhau và việc sử dụng thông tin bổ sung có trong WHODrug, chẳng hạn như thành phần, hình thức, hàm lượng hoặc quốc gia bán hàng có thể giúp phân biệt các tên thương mại không phải là duy nhất này để đơn giản hóa việc xác định sản phẩm y tế chính xác và để tạo thuận lợi cho việc xem xét dữ liệu được mã hóa.
Kết nối Thành phần với (các) Biến thể tương ứng
Theo logic mã thuốc của WHODrug, tất cả các biến thể của thành phần, ví dụ như muối và các bộ phận của cây, được kết nối với phần hoạt động của thành phần, tức là nhóm hoạt động “active moiety”. Điều này có nghĩa là Số Hồ sơ Thuốc “Drug Record Number” giống nhau đối với tất cả các biến thể thành phần có cùng nhóm hoạt chất, nhưng Seq 1 thì khác. Tất cả các tên thương mại chứa biến thể thành phần giống nhau cũng được kết nối với cùng một loại hoạt chất (Hình minh họa - Figure 3).
Phân loại hóa chất điều trị giải phẫu trong WHODrug
Hệ thống phân loại Hóa chất Giải phẫu Trị liệu (ATC - Anatomical Therapeutic Chemical ) theo cấp bậc được tích hợp trong WHODrug. Hệ thống ATC được duy trì bởi Trung tâm Hợp tác về Phương pháp Thống kê Thuốc của WHO (WHO Collaborating Centre for Drug Statistics Methodology) và phân loại các thành phần hoạt tính theo cơ quan hoặc hệ thống mà chúng hoạt động. cũng như các đặc tính trị liệu, dược lý và hóa học của chúng. Tất cả các loại thuốc trong WHODrug đều được chỉ định một hoặc một số mã ATC tùy theo các chỉ định khác nhau của sản phẩm hoặc thành phần thuốc. Ngoài hệ thống phân loại ATC, WHODrug còn sử dụng hệ thống phân loại Herbal ATC (HATC) khi phân loại các bài thuốc thảo dược. Hệ thống HATC ban đầu được phát triển bởi UMC để cung cấp một danh pháp hài hòa và toàn cầu để phân loại liệu pháp điều trị bằng thảo dược.
Sử dụng cấu trúc của WHODrug
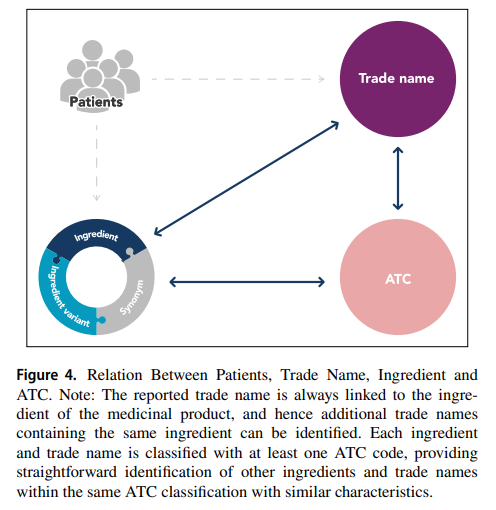
Ngoài mối quan hệ giữa tên thương mại và thành phần và mối liên hệ giữa nhóm hoạt chất của thành phần và biến thể thành phần tương ứng, mã ATC được chỉ định trong WHODrug giúp có thể tổng hợp thuốc theo nhiều cách khác nhau dựa trên, ví dụ như thành phần hoạt tính, thành phần hóa học. lớp hoặc sử dụng điều trị (Hình minh họa - Figure 4). Các loại thuốc tổng hợp này có thể được sử dụng để xác định và phân tích các tác dụng phụ, để xác định tác dụng của một nhóm thuốc nhất định trong việc phát hiện tín hiệu an toàn hoặc làm điểm khởi đầu trong việc phát triển danh sách vi phạm giao thức và danh sách thuốc quan tâm khác trong các thử nghiệm lâm sàng. Ví dụ: nếu một biến cố bất lợi bị nghi ngờ có liên quan đến một sản phẩm thuốc cụ thể, thì bằng cách sử dụng cấu trúc tích hợp sẵn trong WHODrug, tất cả các tên thương mại khác có cùng thành phần có thể được xác định và điều tra các biến cố bất lợi tương tự. Ngoài ra, một loại thuốc dùng đồng thời không kê đơn có thể đã được sử dụng để điều trị chỉ định về tác dụng phụ do thuốc thử nghiệm gây ra và việc xác định mức độ thường xuyên sử dụng thuốc không kê đơn đó của đối tượng nghiên cứu sẽ cung cấp thêm thông tin chi tiết về chính tác dụng phụ đó.
Bằng cách cũng xem xét loại ATC được chỉ định cho thuốc đã xác định, số lượng thuốc quan tâm có thể được mở rộng hơn nữa để tìm các loại thuốc tương tự hoặc các kết hợp thuốc khác có liên quan đến cùng một tác dụng phụ. Bằng cách phân tích tất cả các loại thuốc thu được, người ta có thể xác định xem tác dụng phụ được báo cáo có phải là tác dụng phụ của nhóm hay không, cụ thể là tác dụng phụ của thuốc được sản xuất bởi tất cả các thành viên của một nhóm thuốc liên quan đến dược phẩm. Việc phân loại ATC cũng có thể được sử dụng để xác định các chỉ định phổ biến trong số các loại thuốc được sử dụng để tìm kiếm các tương tác thuốc-thuốc tiềm năng. Một ví dụ về cách cấu trúc của WHODrug có thể được sử dụng để phát hiện tín hiệu là trong trường hợp của desogestrel. Mối quan hệ tiềm ẩn giữa desogestrel và các cơn hoảng loạn ban đầu được nhấn mạnh là một ADR đáng ngờ khi được xác định trong quá trình phát hiện tín hiệu khi một số báo cáo trong VigiBase với thuật ngữ MedDRA “các cơn hoảng loạn và rối loạn” được báo cáo cùng với desogestrel đơn trị liệu. Bằng cách tìm kiếm thành phần desogestrel trong WHODrug, phân tích có thể được mở rộng để bao gồm tất cả các báo cáo về các sản phẩm thuốc có chứa desogestrel, bất kể tên thương mại của chúng.
|